
<ul id="aocae"></ul> <ul id="aocae"></ul> 
日期:2023-05-05點擊:
近日,中國科學技術大學龍冬教授課題組在膜蛋白取向動力學的核磁共振波譜分析領域取得重要進展,相關成果以“Quantitative Paramagnetic NMR-Based Analysis of Protein Orientational Dynamics on Membranes: Dissecting the KRas4B-Membrane Interactions”為題發表于《美國化學會志》(Journal of the American Chemical Society)。
外周膜蛋白可通過疏水、靜電等非共價作用附著于質膜(plasma membrane)表面,并參與分子信號轉導在內的諸多重要細胞事件。在膜環境中,蛋白質分子相對脂質雙分子層的取向并不固定,而是快速地在不同的取向狀態間相互轉換,具有不同程度的旋轉自由度。近年來的研究表明外周膜蛋白的生物學功能高度依賴其在膜表面的空間取向,并受其旋轉動態過程的調控。如何在原子分辨尺度精確表征蛋白質分子在脂質雙分子層表面的功能性取向運動是該領域的前沿問題。
在本研究中,龍冬教授課題組發展了針對膜-蛋白二元體系的順磁弛豫增強分析技術,實現對外周膜蛋白取向圖景(orientational landscape)的高精度刻畫。該工作發現并定量解釋了常規膜順磁弛豫增強(mPRE)實驗中膜內自旋探針泊松分布對質子順磁弛豫增強速率的扭曲效應,并對不同定性和定量順磁弛豫參數的失真程度給出了理論評估和實驗驗證。為消除這一系統誤差,該項研究利用瞬時膜-蛋白復合系統準確測量了外周膜蛋白的未失真mPRE速率,并在此基礎上發展了一項新的基于mPRE實驗參數的建模方法,用于準確還原生物大分子在膜表面的玻爾茲曼取向分布。這一定量mPRE方法被應用于癌基因蛋白KRas4B,精確刻畫了其在不同成分磷脂雙分子層表面的取向運動,揭示了該分子中催化結構域和C末端天然無序結構區域在塑造其取向圖景時起到的獨特作用。值得一提的是,作為經典膜外周蛋白,KRas4B與下游效應分子及小分子抑制劑的相互作用受其在膜表面空間取向的嚴格調控。該項研究工作構建的高精度KRas4B取向動力學模型對深刻理解其信號轉導機理和藥物設計都至關重要。
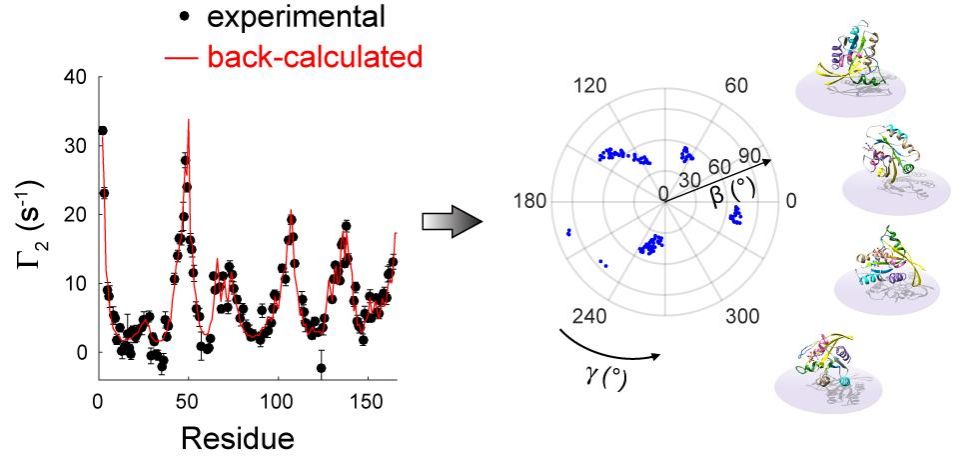
圖1.mPRE核磁共振波譜法定量揭示KRas4B在脂質雙分子層表面的取向分布
該課題組博士研究生古雪、博士后柳丹為論文共同第一作者。該研究工作得到科技部、基金委和中央高校基本科研業務費的資助。
論文鏈接:https://pubs.acs.org/doi/10.1021/jacs.3c01597
(生命科學與醫學部、科研部)