中國科學技術大學生命科學與醫學部周叢照教授課題組,利用冷凍電鏡單顆粒技術解析侵染模式藍藻—魚腥藻PCC 7120的肌尾噬藻體A-1(L)尾部機器的完整三維結構,結合一系列生化實驗鑒定多個識別和水解宿主的關鍵功能模塊,并基于結構信息重注釋其基因組,揭示A-1(L)與其特異性宿主藍藻相互作用的結構基礎和分子機制,相關成果以“Structure of the intact tail machine of Anabaena myophage A-1(L)”為題于2024年3月26日在線發表在《Nature Communications》上。
藍藻利用光能將二氧化碳轉化為生物質,參與調控生物圈的碳氮循環。頻繁的人類活動引起水生生態系統中氮磷的輸入量急劇增加,導致嚴重的水體富營養化,藍藻大量繁殖而形成水華。噬藻體作為特異性侵染藍藻的噬菌體,與宿主相互作用可引發宿主細胞裂解或代謝重編程,參與水生生態系統的能量分流和物質循環、藍藻種群密度和豐度的調節等。然而,噬藻體通常具有極強的宿主特異性,且目前噬藻體的研究主要集中在海洋噬藻體,對淡水噬藻體與宿主之間相互作用的深入研究仍然較少。這極大限制了噬藻體的工程化改造,以及將其作為一種環境友好的制劑應用于調控藍藻水華。
魚腥藻PCC 7120是一種絲狀固氮藍藻,具有成熟的遺傳操作系統,已成為研究藍藻的理想模式生物。A-1(L)是一株于20世紀70年代分離的肌尾噬藻體,能夠特異性侵染魚腥藻PCC 7120,在與宿主長期進化過程中相生相殺。因此,噬藻體A-1(L)與魚腥藻PCC 7120可作為研究噬藻體和藍藻相互作用的理想模型。
在前期報道A-1(L)正二十面體衣殼結構的基礎上(JournalofVirology, 2021),研究人員進一步解析其三組分尾部機器的結構,包括頸部、尾部和附著的纖維(圖一)。頸部由十二聚體門戶蛋白、十五聚體接頭蛋白和六聚體連接蛋白組成,外側錨定著五根獨立組裝的串珠狀頸部纖維。可收縮的尾部由24個尾管蛋白六元環和24個尾鞘蛋白六元環圍繞著中央的卷尺蛋白組成。尾部末端榫卯結構的基板包含五個組分:尾尖蛋白-中心蛋白組成的中央三聚體核心,兩種構象的六個栓塞蛋白亞基連接內部的三聚體核心和外部六重對稱的楔形蛋白異源三聚體。六根長尾纖和六根短尾纖成對折疊,其中一端固定在基板上,另一端折回貼近衣殼。通過結構分析結合生化實驗進一步鑒定基板中心蛋白的雙重水解活性和兩種尾纖的受體結合活性(圖二)。此外,A-1(L)的完整結構幫助我們重注釋了其基因組,將注釋基因的比例提高至60%。該研究有助于我們深入理解噬藻體與宿主藍藻相互作用的分子機制,為將來開發環境友好型底盤噬藻體奠定理論基礎。
中國科學技術大學周叢照教授和李瓊副教授為該論文的共同通訊作者,博士生余榮成為該論文的第一作者。冷凍電鏡數據收集工作在中國科學技術大學冷凍電鏡中心完成,共聚焦成像和質譜在中國科學技術大學生命科學實驗中心完成。上述研究得到國家自然科學基金、國家科技部和中央高校基礎科研業務費的資助支持。
全文鏈接:https://www.nature.com/articles/s41467-024-47006-z
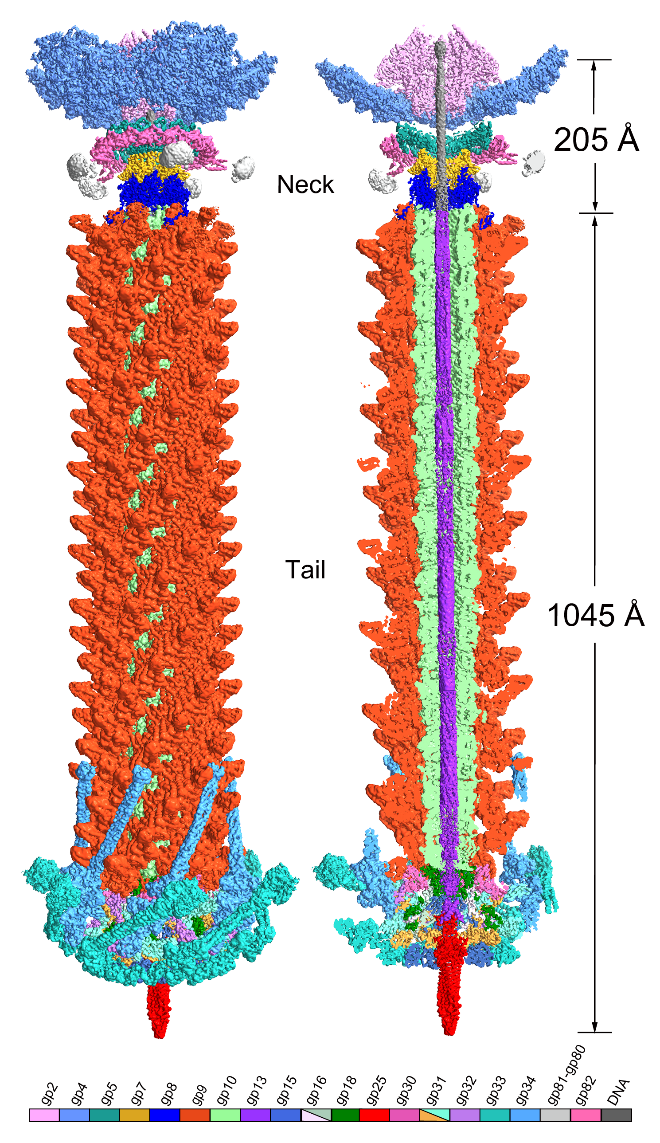
圖一 噬藻體A-1(L)尾部機器的完整結構
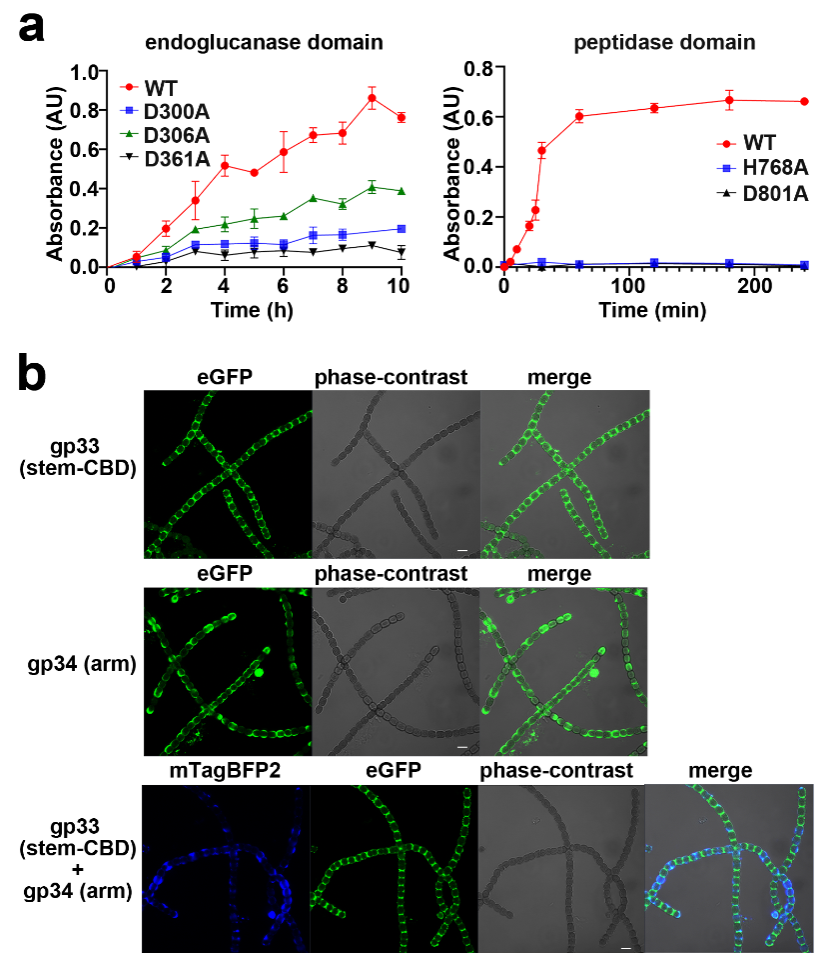
圖二 A-1(L)基板中心蛋白的雙重水解活性和兩種尾纖的受體結合活性
(生命科學與醫學部、科研部)

