中國科學技術大學生命科學與醫學部周叢照教授和陳宇星教授課題組,利用單顆粒冷凍電鏡技術解析了三種不同狀態的硝酸鹽/亞硝酸鹽ABC轉運蛋白NrtABCD(縮寫為NRT)的三維結構,包括結合底物硝酸根NO3-、結合Mg2+-ATP以及結合信號蛋白PII的結構。基于結構和生化分析以及生理實驗,作者闡明了一種新型ABC轉運蛋白的底物識別模式和轉運循環,以及PII如何通過響應不同的效應分子進而精細調控NRT轉運活性的分子模型。相關研究成果以“Allosteric regulation of nitrate transporter NRT via the signaling protein PII”為題于3月8日在線發表于《美國科學院院報》上。
碳氮代謝平衡是細胞正常生長和處于穩態的前提。藍細菌作為一種古老的光合自養型原核生物,進化出由多種轉錄因子和信號蛋白調控的碳氮代謝網絡。其中,作為目前分布最廣泛的蛋白家族之一,信號轉導蛋白PII響應細胞內代謝小分子和能量的變化,進而調控多種靶蛋白的活性,維持碳氮平衡。在銨鹽缺乏的情況下,藍細菌通過激活硝酸鹽同化通路將硝酸鹽/亞硝酸鹽轉運到細胞內并還原為銨,從而為其生長提供氮源。研究表明,PII能與硝酸鹽/亞硝酸鹽轉運蛋白NRT互作進而調控硝酸鹽同化通路的活性。NRT由5個蛋白亞基組成:一個底物結合蛋白(SBP)NrtA、兩個相同的跨膜亞基(TMD)NrtB以及兩個不同的核苷酸結合亞基(NBD)NrtC和NrtD,屬于ABC轉運蛋白家族的I型ABC importer。與經典ABC轉運蛋白不同,其NrtC亞基的C端融合了一個與NrtA相似的調控結構域(CRD),被認為可能參與調控NRT的活性。目前,關于這種新型ABC轉運蛋白的結構和轉運機理,以及PII如何識別NRT進而調控藍細菌碳氮平衡的分子機理仍不清楚。
作者解析了NrtBCD三種不同狀態的三維結構。其中,結合底物硝酸根的NrtBCD-NO3-結構呈現向內開口(inward-facing)的構象,TMD中存在一個由結合硝酸根的疏水腔和富含精氨酸殘基的親水腔組成的連續的底物轉運通道,負責底物的進入和釋放。在結合Mg2+-ATP的NrtBCD-ATP結構中,ATP的結合引發NBD相互靠近,導致TMD發生構象變化,底物轉運通道被封閉,形成封閉的向外開口(outward-facing occluded)的構象。NrtBCD-PII復合物結構采用了一種完全不對稱的抑制型構象(圖1)。與以前報道的PII通過T-loop結合靶蛋白的方式不同,NrtBCD-PII中的PII通過核心結構域中的T-loop基部、B-loop和C-loop等元件同時結合NrtC的NBD和CRD結構域,代表了一種新的相互作用模式。作者通過結構分析結合生化生理實驗提出了PII通過調控NRT活性進而維持藍細菌碳氮平衡的分子模型(圖2):在高N/C比時,PII通過與NrtC直接結合進而與NRT形成復合物,將NRT鎖定為抑制型向內開口(inhibited inward-facing)的構象,同時跨膜區的底物轉運通道收窄,抑制了NRT的硝酸鹽/亞硝酸鹽轉運活性。而在低N/C比時,細胞內的α-酮戊二酸(2-OG)累積,此時2-OG結合PII并導致PII發生構象變化,使其從NrtC上解離下來,NRT轉運活性得以恢復,向胞內轉運硝酸鹽/亞硝酸鹽,維持碳氮平衡。本研究不僅闡明了信號蛋白PII與靶蛋白的一種新型互作模式,還發現了一種非對稱的ABC轉運蛋白的調控模式,拓展了藍細菌的碳氮代謝平衡調控網絡。
中國科學技術大學周叢照教授、江永亮副教授和陳宇星教授為該論文的共同通訊作者,博士生李波為該論文的第一作者。冷凍電鏡數據收集工作在中國科學技術大學冷凍電鏡中心完成。該研究工作得到中國科學院、國家自然科學基金委、科技部和安徽省科技廳的資助。
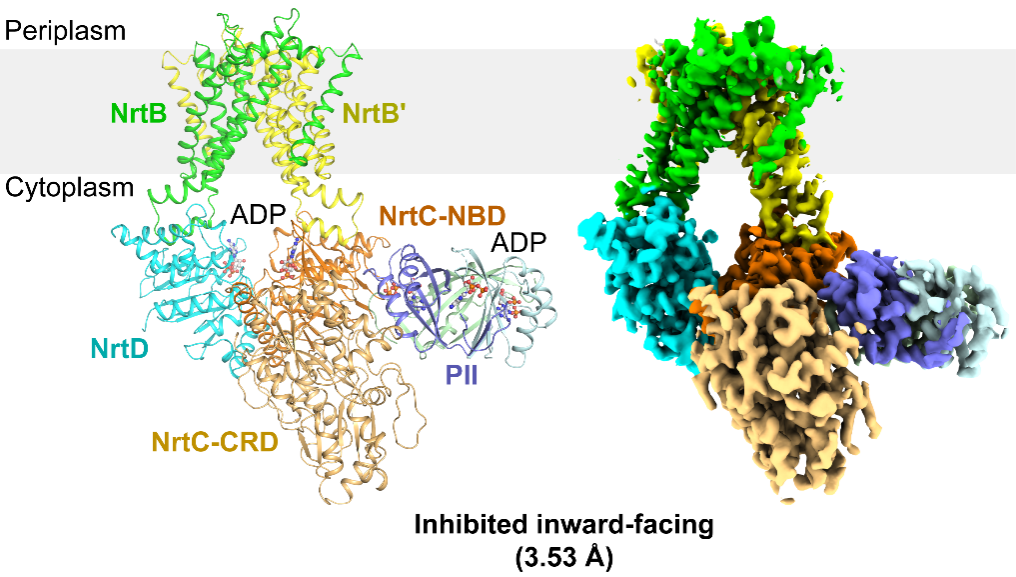
圖1.NrtBCD-PII復合物的三維結構
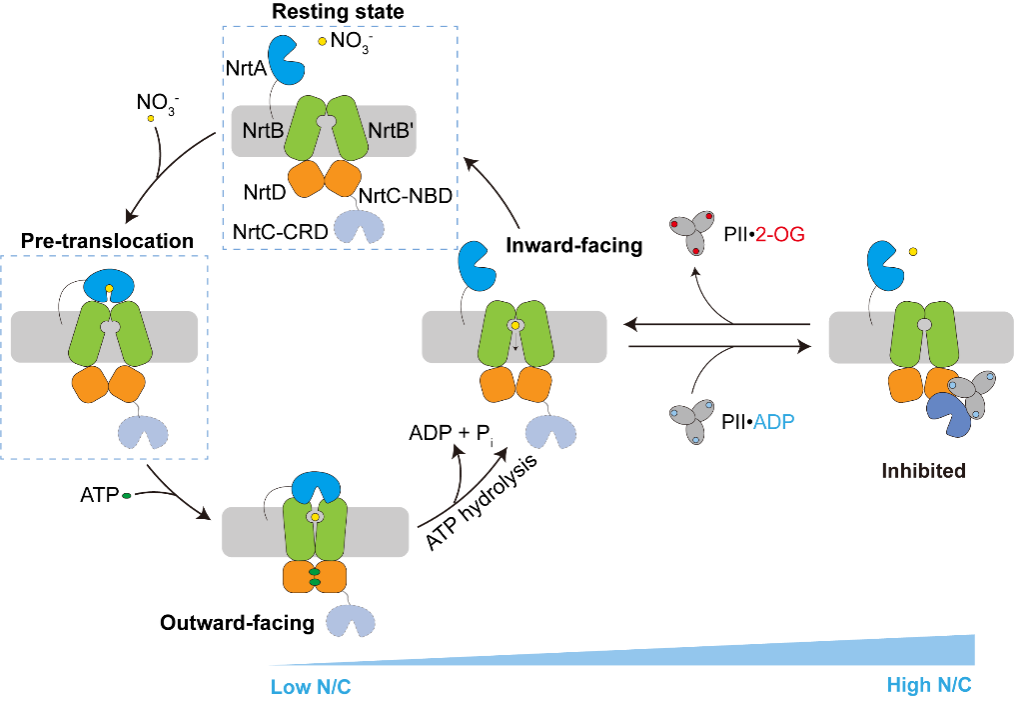
圖2.PII調控NRT轉運循環的模式圖
原文鏈接:https://www.pnas.org/doi/10.1073/pnas.2318320121
(生命科學與醫學部、科研部)

