
<ul id="aocae"></ul> <ul id="aocae"></ul> 
日期:2024-04-28點擊:
年齡的增長和體重的增加都會給身體細胞帶來壓力,主要表現為活性氧自由基(ROS)的過度生成。在氧化應激條件下,過量的ROS會破壞細胞蛋白、脂質和DNA,對細胞造成致命損傷,進而導致與肥胖和衰老相關的代謝疾病,比如糖尿病和脂肪肝。雖然抗氧化劑和ROS清除劑可以緩解代謝功能障礙,并且一些抗氧化劑已經在臨床環境中進行了試驗,但長期抗氧化治療存在潛在的安全問題,目前還沒有理想的藥物可用。因此,了解氧化應激導致的脂質代謝功能障礙的分子機制至關重要。
4月13日,中國科大附一院(安徽省立醫院)內分泌科葉山東、鄭茂團隊聯合安徽醫科大學基礎醫學院方皓舒教授團隊在《自然通訊(Nature Communications)》發表題為《脂多糖結合蛋白通過調節脂滴穩態抵抗肝臟氧化應激壓力(Lipopolysaccharide binding protein resists hepatic oxidative stress by regulating lipid droplet homeostasis)》的研究論文,首次提出“氧化應激躲避”的概念,原創性報道機體調控氧化應激壓力全新機制,為理解細胞如何應對氧化應激提供了新見解,為對緩解氧化應激引起的代謝功能障礙及基于氧化還原平衡調控的新治療策略開發提供了新思路,也為代謝性疾病的預防和治療提供了新方向。

代謝相關性脂肪肝病是一種以肝細胞內甘油三酯積累為主要特征的病變,主要表現為脂滴的積累。脂滴作為脂質儲存的主要細胞器,正常情況下,脂滴主要發揮調節能量代謝的作用。
在氧化應激下,脂滴作為細胞“氧化應激躲避”的關鍵細胞器之一,積累大量易受ROS攻擊的不飽和甘油三酯(UFA-TG)以防止進一步過氧化,從而維持脂質穩態。然而,氧化應激下發生“氧化應激躲避”的分子機制尚不清楚,UFA-TG的細胞分選機制急需闡明。
該研究指出,當細胞處于氧化應激狀態時,脂多糖結合蛋白(LBP)的表達水平會增加,并聚集在脂滴中。LBP具有脂質捕獲活性,通過其C端的疏水結構捕獲脂質,并將其運送至脂滴,從而控制脂質-氧化穩態。研究人員還發現,還原劑N-乙酰-L-半胱氨酸處理可以清除細胞內的活性氧并增加磷脂合成。磷脂可以與甘油三脂競爭性結合LBP,促進LBP轉運出脂滴并促進脂解。但是,在氧化應激未消除的環境下,使用磷脂治療脂肪肝可能造成更嚴重的肝細胞損傷。PRDX4作為細胞氧化還原信號的感應器,通過與LBP互作來調控LBP/甘油三酯的脂滴穿梭過程,維持細胞氧化還原穩態。此外,長期的壓力刺激應激會上調LBP表達,進而導致胰島素抵抗和肥胖。
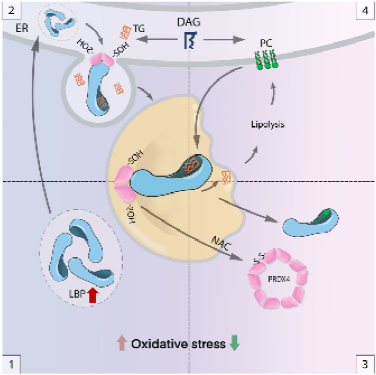
LBP響應氧化應激維持脂滴穩態工作模式圖
圖注:1.LBP響應氧化應激并表達上調;2. LBP從ER轉移到LD以促進LD增長;3. 氧化應激消退后PRDX4的進入分解再生途徑從而促進LBP離開LDs;4. LBP離開LDs并增強脂解和磷脂合成。
這項研究成果揭示了氧化應激誘導脂質積累的機制。脂多糖結合蛋白作為一種抗氧化劑和“氧化應激躲避”的核心分子,是連接壓力-氧化應激-代謝紊亂-肥胖的重要樞紐。其與脂質代謝和氧化還原信號通路相連接,精確地維持細胞內穩態以適應氧化應激。抗氧化療法是一種治療由脂多糖結合蛋白引起肥胖的潛在方法。
中國科大附一院內分泌科糖尿病研究室博士研究生張啟倫、安徽醫科大學基礎醫學院博士研究生沈徐婷、碩士研究生袁欣為本文的共同第一作者;中科大附一院內分泌科糖尿病研究室葉山東教授、鄭茂主任,安徽醫科大學基礎醫學院方皓舒教授為本文的共同通訊作者;來自華中科技大學同濟醫院、中國科學技術大學、國家蛋白質中心的多位專家教授也為該項目研究做出了重要貢獻。該研究獲得國家自然科學基金、安徽省地方科技發展專項基金、科大新醫學基金等經費支持。
論文鏈接:https://www.nature.com/articles/s41467-024-47553-5
(附屬第一醫院、生醫部、科研部)